此外,在肺癌的動物實驗同時使用EpAb2-6和PD-L1抗體Atezolizumab的「聯合療法」,可有效抑制腫瘤的生長。這些發現不僅更深入剖析EpCAM促使癌症惡化的分子機制,對未來臨床上治療EpCAM過量表現的癌症,也提供了結合免疫療法的新策略。
吳漢忠主任表示:「EpCAM可見於許多種癌細胞,如:大腸癌、肺癌、口腔癌、胰臟癌等,因此,可以預見這項研究成果未來將被廣泛應用在各種不同的癌症診斷和治療。」經實驗證實,這種中和性抗體EpAb2-6能與多種癌細胞的EpCAM結合,也能有效抑制腫瘤的生長和轉移,延長小鼠壽命。
目前,此人類化中和性抗體EpAb2-6在癌症的診斷、標靶治療及造影的應用,深具發展潛力,已取得世界多國的專利,並獲科技部價創計畫5,000萬元的支持,成立新創公司進駐國家生技研究園區,未來可望化研為用,造福人群。
EpCAM蛋白對人體並非只有負面影響!可應用在幹細胞研究、組織工程或再生醫學上
值得注意的是,EpCAM對人體並非只有負面影響。在一系列開創性的研究中,吳漢忠團隊發現它其實對人體的幹細胞有正面的幫助。例如:EpCAM會高度表現在未分化的人類胚胎幹細胞,可直接調控多能基因,幫助維持胚胎幹細胞的多能性。此外,研究團隊也透過EpCAM,推進了2012年諾貝爾得主山中伸彌的研究成果。
原本,使纖維母細胞重編程成為誘導型多能幹細胞需要4個山中伸彌因子,但有了EpCAM,只需1個山中伸彌因子即可成功;而團隊也發現EpCAM對骨頭的生成亦有幫助。總而言之,這些研究成果有助於開發更高效的重編程策略及維持幹細胞的多能性,代表EpCAM蛋白也可應用在幹細胞的研究、組織工程或再生醫學等。
本次研究論文:EpCAM signaling promotes tumor progression and protein stability of PD-L1 through the EGFR pathway將於2020年11月16日正式發表。研究團隊有吳漢忠特聘研究員及2位共同第一作者:碩士生陳皓年與梁剛豪博士。論文全文:https://cancerres.aacrjournals.org/content/80/22/5035。
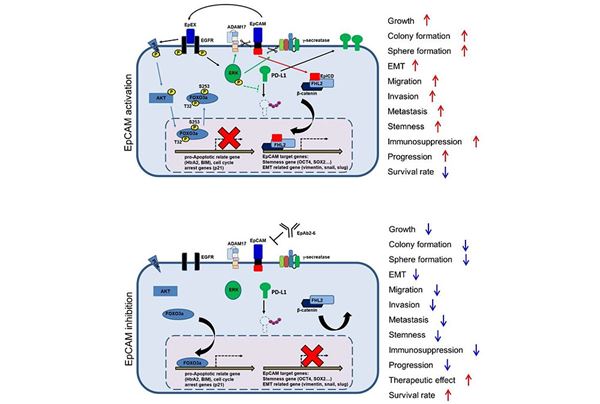
圖說:研究團隊發現EpCAM的細胞外區域(EpEX)可以藉由其EGF相似區域一結合EGFR,活化下游的AKT與MAPK訊息傳遞,進而抑制與細胞凋亡相關的轉錄因子FOXO3a的作用,並穩定免疫檢查點蛋白之PD-L1配體的表現,最終促使癌症惡化。在利用EpAb2-6抑制EpCAM/EpEX活性下,可以降低AKT與FOXO3a的磷酸化,進而活化並增加FOXO3a在細胞核的累積與其下游基因HtrA2的表現,最終導致細胞產生細胞凋亡。EpAb2-6也可以藉由降解PD-L1蛋白,進而增加CD8+T細胞毒殺癌細胞的能力。


 體味變重是「加齡臭」嗎?小心肝腎功能出問題,8招有效告別老人味
體味變重是「加齡臭」嗎?小心肝腎功能出問題,8招有效告別老人味
 小女孩抱怨癢癢?不自主地抓下體?上廁所這一習慣沒注意,小心前庭炎上門
小女孩抱怨癢癢?不自主地抓下體?上廁所這一習慣沒注意,小心前庭炎上門
 晚餐吃水果不只容易變胖?還會養成脂肪肝體質?營養師教你吃對不NG
晚餐吃水果不只容易變胖?還會養成脂肪肝體質?營養師教你吃對不NG
 北慈攝護腺癌平均五年存活率優於全國!早期診斷攝護腺癌,「這個」是新利器
北慈攝護腺癌平均五年存活率優於全國!早期診斷攝護腺癌,「這個」是新利器
 肩膀、手臂刺痛灼熱感,竟是帶狀疱疹發作!醫師教分辨帶狀疱疹、頸椎神經根病變
肩膀、手臂刺痛灼熱感,竟是帶狀疱疹發作!醫師教分辨帶狀疱疹、頸椎神經根病變
 吃辣椒減重越吃越涮嘴,肥胖與脂肪肝風險卻越高?醫:辣椒助減重掌握3大關鍵
吃辣椒減重越吃越涮嘴,肥胖與脂肪肝風險卻越高?醫:辣椒助減重掌握3大關鍵








 闽公网安备 35020302001899号
闽公网安备 35020302001899号
